Navegação Periódicos - Resumos por ano de publicação "2023"
- Página inicial
- →
- IPEN
- →
- Periódicos - Resumos
- →
- Navegação Periódicos - Resumos por ano de publicação
- Sobre
- Perfil Técnico
- Política de funcionamento
- Ajuda
- Apresentação
Navegação Periódicos - Resumos por ano de publicação "2023"
Itens para a visualização no momento 1-4 de 4
-
. Proteolytic activity of secreted proteases from pathogenic leptospires and effects on phagocytosis by murine macrophages. Immunobiology, v. 228, n. 5, p. 45, 2023. DOI: 10.1016/j.imbio.2023.152562 Abstract: Leptospirosis is a zoonosis caused by spirochete bacteria that belong to the genus Leptospira. This disease represents a serious public health problem, especially in developing countries with tropical and subtropical temperatures. Pathogenic leptospires escape from the Complement System, a property that permits them to survive in vitro when in contact with normal human serum (NHS). In a previous study carried out by our group, it was observed that culture supernatants from different pathogenic species of leptospires (SPL) contain proteases that cleave many Complement proteins, including the central molecule C3 and its fragments C3b and iC3b. Our hypothesis is that these proteases, could decrease the phagocytic clearance of leptospires. Using flow cytometry, we observed decreased amounts of CR3 and CR4 in murine peritoneal macrophages treated with SPL for 24 h. By confocal microscopy, we observed reduction in TLR2, CD11b and CD206 levels when these cells were treated with SPL and recombinant thermolysin for 24 h. Furthermore, opsonins such as C3b/iC3b deposited on the surface of pathogenic leptospires were observed to be completely degraded in the presence of SPL or recombinant thermolysin. Finally, we decided to investigate the phagocytosis of pathogenic leptospires by macrophages in the presence of these proteases. We observed an increase of phagocytosis of leptospires opsonized with normal mouse serum even when macrophages were treated with the proteases. However, when opsonized bacteria were also incubated with SPL, recombinant thermolysin and recombinant leptolysin., there was a decline in leptospires phagocytosis. This suggests that the proteolytic activity can affect phagocytosis by peritoneal macrophages mainly through the degradation of opsonins deposited in the membrane of leptospires. These observations lead us to suggest that proteases secreted by pathogenic leptospires could degrade opsonins present in normal serum or deposited in the bacterial membrane as well as cleave or inhibit macrophage surface molecules. Therefore, these proteases could interfere with the recognition and internalization by murine macrophages, favoring the spread of leptospires in the host.. Proteolytic activity of secreted proteases from pathogenic leptospires and effects on phagocytosis by murine macrophages. Immunobiology, v. 228, n. 5, p. 45, 2023. DOI: 10.1016/j.imbio.2023.152562. Disponível em: http://repositorio.ipen.br/handle/123456789/34407. Acesso em: $DATA.Como referenciar este item
Esta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Leptospira interrogans leptolysin displays proteolytic activity against complement proteins. Immunobiology, v. 228, n. 5, p. 85, 2023. DOI: 10.1016/j.imbio.2023.152651 Abstract: Pathogenic Leptospira species are extremely efficient in disseminating in the host, a fact attributed to their ability to escape complement system activation, and to degrade extracellular matrix and other components of the human plasma. Recently, our group evaluated the proteolytic activity of secreted proteins by leptospires, and exoproteome analyzes of these bacteria allowed the identification of some proteases, including the metalloprotease pappalysin-1 domain protein, which we named leptolysin. In this work we produced and functionally characterized leptolysin from L. interrogans to expand our knowledge on this metalloprotease from Leptospira in the processes of invasion and immune evasion. According to in silico analyzes this protease belongs to the category of short pappalysins, also found in other bacteria. Leptolysin is present in all Leptospira species but is more conserved among pathogenic species of the P1 subclade. A preliminary biochemical characterization of its proteolytic activity was performed using FRET (Free Resonance Energy Transfer) peptides. The enzyme exhibited maximum activity at pH 8.0 and 37 C, was active in the presence of different salts and was strongly inhibited by EDTA and 1,10-phenanthroline. It showed a marked preference for arginine residues in the P1 position. The proteolytic activity of recombinant leptolysin on host molecules was also evaluated in vitro and in vivo. The metalloprotease was active against extracellular matrix proteins (proteoglycans and fibronectin), coagulation cascade molecules (fibrinogen and thrombin) and effector proteins of the human complement system (C2 to C9). A leptolysin knockout strain (Dlic13434) was produced and characterized. This strain showed lower survival in normal human serum (SHN) compared to the wild-type strain. However, in a model of epicutaneous infection in hamsters, no attenuation of virulence was observed with the knockout strain, although the bacterial load in the kidneys of these animals was lower than that observed in animals inoculated with the wild-type strain. Finally, data with sera from leptospirosis patients suggest that leptolysin is produced during natural infections by pathogenic leptospires. The characterization of toxins, their targets and mechanisms of action can help in the development of strategies to combat leptospirosis.. Leptospira interrogans leptolysin displays proteolytic activity against complement proteins. Immunobiology, v. 228, n. 5, p. 85, 2023. DOI: 10.1016/j.imbio.2023.152651. Disponível em: http://repositorio.ipen.br/handle/123456789/34404. Acesso em: $DATA.Como referenciar este item
Esta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Latin America Optics and Photonics 2022: introduction to the feature issue. Applied Optics, v. 62, n. 8, p. 1-2, 2023. DOI: 10.1364/AO.489414 Abstract: The 2022 Latin America Optics and Photonics Conference (LAOP 2022), the major international conference sponsored byOptica in Latin America, returned to Recife, Pernambuco, Brazil, after its first edition in 2010.Held every two years since (except for 2020), LAOP has the explicit objective to promote Latin American excellence in optics and photonics research and support the regional community. In the 6th edition in 2022, it featured a comprehensive technical program with recognized experts in fields critical to Latin America, highly multidisciplinary, with themes frombiophotonics to2Dmaterials. The 191 attendees of LAOP2022 listened to five plenary speakers, 28 keynotes, 24 invited talks, and 128 presentations, including oral and posters
Palavras-Chave: optical activity; photon emission; lasers; fiber optics; meetings
. Latin America Optics and Photonics 2022: introduction to the feature issue. Applied Optics, v. 62, n. 8, p. 1-2, 2023. DOI: 10.1364/AO.489414. Disponível em: http://repositorio.ipen.br/handle/123456789/34097. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Financing the line of care in the first biochemical relapse of prostate cancer after [68Ga] PSMA PET- CT. International Journal of Technology Assessment in Health Care, v. 38, n. S1, p. S57-S57, 2023. DOI: 10.1017/S0266462322001891. Financing the line of care in the first biochemical relapse of prostate cancer after [68Ga] PSMA PET- CT. International Journal of Technology Assessment in Health Care, v. 38, n. S1, p. S57-S57, 2023. DOI: 10.1017/S0266462322001891. Disponível em: http://repositorio.ipen.br/handle/123456789/34403. Acesso em: $DATA.Como referenciar este item
Esta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
Itens para a visualização no momento 1-4 de 4
Buscar no repositório
Navegar
Minha conta
Visualizar
A pesquisa no RD utiliza os recursos de busca da maioria das bases de dados. No entanto algumas dicas podem auxiliar para obter um resultado mais pertinente.
✔ É possível efetuar a busca de um autor ou um termo em todo o RD, por meio do Buscar no Repositório , isto é, o termo solicitado será localizado em qualquer campo do RD. No entanto esse tipo de pesquisa não é recomendada a não ser que se deseje um resultado amplo e generalizado.
✔ A pesquisa apresentará melhor resultado selecionando um dos filtros disponíveis em Navegar
✔ Os filtros disponíveis em Navegar tais como: Coleções, Ano de publicação, Títulos, Assuntos, Autores, Revista, Tipo de publicação são autoexplicativos. O filtro, Autores IPEN apresenta uma relação com os autores vinculados ao IPEN; o ID Autor IPEN diz respeito ao número único de identificação de cada autor constante no RD e sob o qual estão agrupados todos os seus trabalhos independente das variáveis do seu nome; Tipo de acesso diz respeito à acessibilidade do documento, isto é , sujeito as leis de direitos autorais, ID RT apresenta a relação dos relatórios técnicos, restritos para consulta das comunidades indicadas.

A opção Busca avançada utiliza os conectores da lógica boleana, é o melhor recurso para combinar chaves de busca e obter documentos relevantes à sua pesquisa, utilize os filtros apresentados na caixa de seleção para refinar o resultado de busca. Pode-se adicionar vários filtros a uma mesma busca.
Exemplo:
Buscar os artigos apresentados em um evento internacional de 2015, sobre loss of coolant, do autor Maprelian.
Autor: Maprelian
Título: loss of coolant
Tipo de publicação: Texto completo de evento
Ano de publicação: 2015
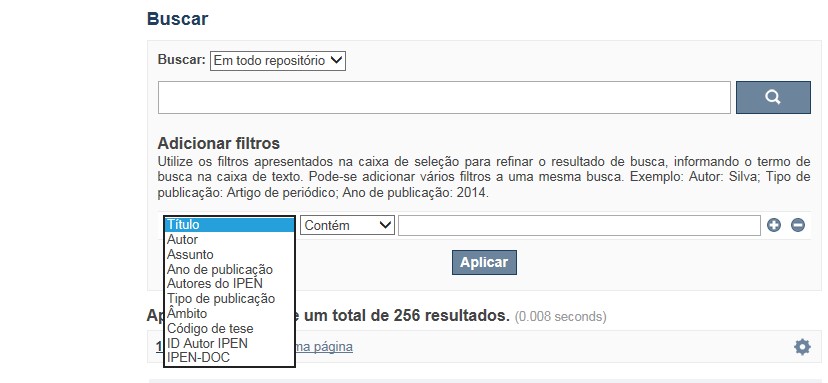
✔ Para indexação dos documentos é utilizado o Thesaurus do INIS, especializado na área nuclear e utilizado em todos os países membros da International Atomic Energy Agency – IAEA , por esse motivo, utilize os termos de busca de assunto em inglês; isto não exclui a busca livre por palavras, apenas o resultado pode não ser tão relevante ou pertinente.
✔ 95% do RD apresenta o texto completo do documento com livre acesso, para aqueles que apresentam o ![]() significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
[email protected]
.
significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
[email protected]
.
✔ Ao efetuar a busca por um autor o RD apresentará uma relação de todos os trabalhos depositados no RD. No lado direito da tela são apresentados os coautores com o número de trabalhos produzidos em conjunto bem como os assuntos abordados e os respectivos anos de publicação agrupados.
✔ O RD disponibiliza um quadro estatístico de produtividade, onde é possível visualizar o número dos trabalhos agrupados por tipo de coleção, a medida que estão sendo depositados no RD.
✔ Na página inicial nas referências são sinalizados todos os autores IPEN, ao clicar nesse símbolo ![]() será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
✔ Na página do pesquisador, é possível verificar, as variações do nome, a relação de todos os trabalhos com texto completo bem como um quadro resumo numérico; há links para o Currículo Lattes e o Google Acadêmico ( quando esse for informado).
ATENÇÃO!
ESTE TEXTO "AJUDA" ESTÁ SUJEITO A ATUALIZAÇÕES CONSTANTES, A MEDIDA QUE NOVAS FUNCIONALIDADES E RECURSOS DE BUSCA FOREM SENDO DESENVOLVIDOS PELAS EQUIPES DA BIBLIOTECA E DA INFORMÁTICA.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
1. Portaria IPEN-CNEN/SP nº 387, que estabeleceu os princípios que nortearam a criação do RDI, clique aqui.
2. A experiência do Instituto de Pesquisas Energéticas e Nucleares (IPEN-CNEN/SP) na criação de um Repositório Digital Institucional – RDI, clique aqui.
O Repositório Digital do IPEN é um equipamento institucional de acesso aberto, criado com o objetivo de reunir, preservar, disponibilizar e conferir maior visibilidade à Produção Científica publicada pelo Instituto, desde sua criação em 1956.
Operando, inicialmente como uma base de dados referencial o Repositório foi disponibilizado na atual plataforma, em junho de 2015. No Repositório está disponível o acesso ao conteúdo digital de artigos de periódicos, eventos, nacionais e internacionais, livros, capítulos, dissertações, teses e relatórios técnicos.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
